مدل اتمی بور در سال ۱۹۱۳ توسط نیلز بور با فرضهای زیر ارائه شد:
۱- الکترون در لایههای مشخصی (ترازهای انرژی) اطراف هستهی اتم در گردش است. برخلاف الکترومغناطیس کلاسیک، این الکترونهای در حال چرخش، انرژی از خود ساطع نمیکنند. این لایهها ثابت و پایدار هستند که هریک فاصله مشخصی از هستهی اتم دارند. الکترون تنها میتواند در این لایهها گردش کند و نمیتواند در فواصل بین این لایهها حضور داشته باشد.
۲- فواصل این لایهها از هستهی اتم بایستی به گونهای باشد که مومنتوم زاویهای الکترون، مضرب صحیحی از ثابت کاهیدهی پلانک (nh) باشد. کمترین مقدار این مضرب صحیح n میتواند یک باشد که مربوط به پایینترین لایهی الکترونی است.
۳- الکترون تنها میتواند با جذب یا ساطع کردن انرژی، بین بین این لایههای مشخص پرش کند. زمانی که الکترون انرژی کافی دریافت کند، به لایههای بالاتر پرش میکند. زمانی که الکترون انرژی از دست بدهد، به لایههای پایینتر سقوط میکند. این انرژی به صورت امواج الکترومغناطیس است و مقادیر این انرژی نیز مشخص و ثابت است.
این مدل اتمی توانست تا حد زیادی کاستیهای مدل اتمی رادرفورد را برطرف کند. از جمله اینکه توانست خطوط طیف اتمی برخی عناصر را توجیه کند.
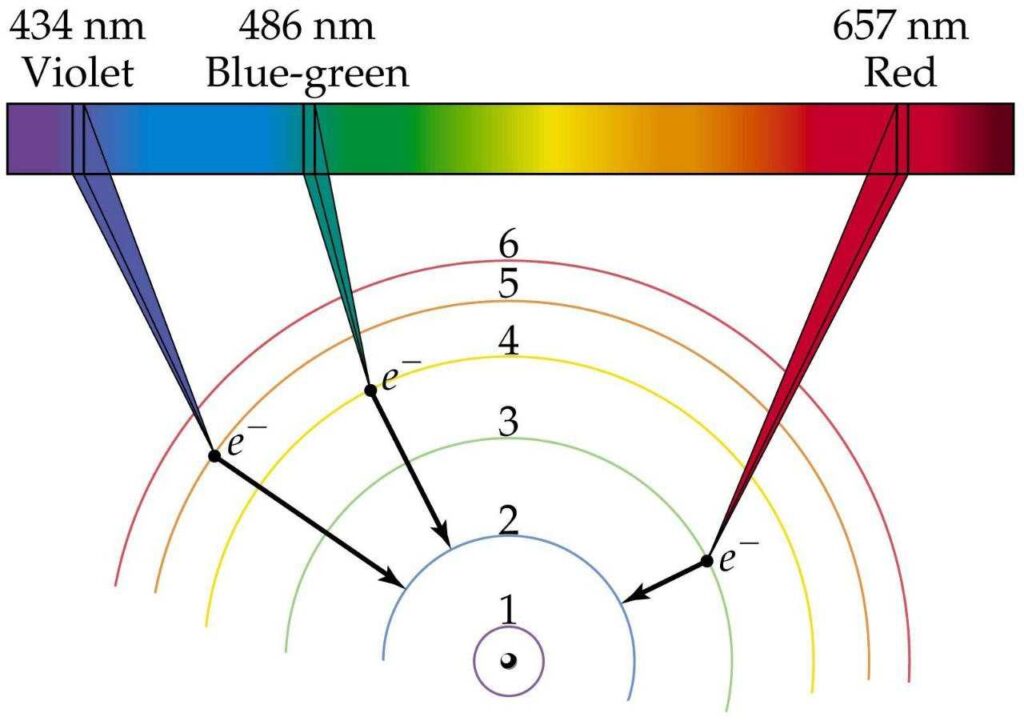
به عنوان مثال یک اتم هیدروژن را در نظر بگیرید. در دمای اتاق، تقریبا تمامی اتمهای هیدروژن در حالت پایه هستند (الکترونهای آنها در لایهی اول n=1 قرار دارند). در دماهای بالاتر و یا در حین یک تخلیهی الکتریکی، اتمها برانگیخته میشوند (الکترونهای آنها به لایههای بالاتر n>1 پرش میکنند). پس از مدتی، الکترونهای که به لایههای بالاتر رفتهاند، مجددا به لایههای پایینتر پرش میکنند و انرژی به صورت امواج الکترومغناطیس با فرکانس مشخص ساطع میکنند که این امواج، همان خطوط تاریک در طیف اتمی هستند.
مدل اتمی بور در کنار موفقیتی که در توجیه برخی پدیدهها داشت، کاستیهای زیادی نیز داشته است.
اما من در اینجا بحث در مورد مدلهای اتمی را به پایان میبرم. آشنایی با مدل اتمی بور، برای درک بهتر عملکرد ساعتهای اتمی کافی بوده و بنابراین بررسی دیگر مدلهای اتمی را به بعد موکول میکنیم.