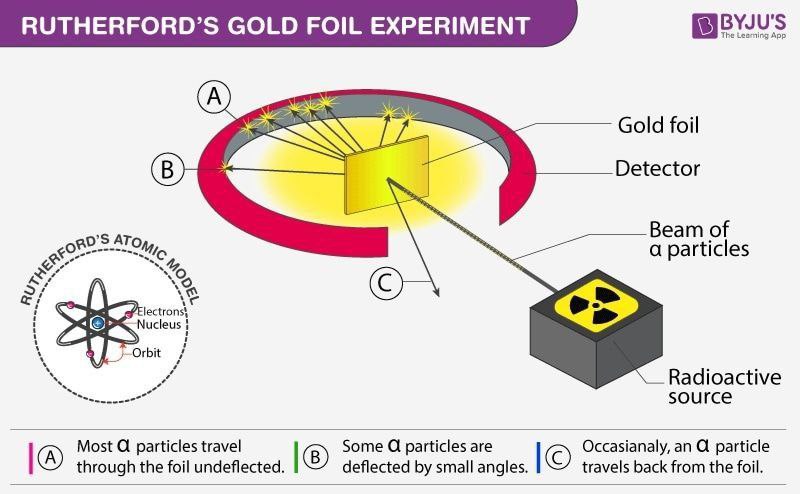
در سال ۱۹۱۱ ارنست رادرفورد آزمایشی طراحی کرد که منجر به ارائهی یک تصویر جدید از اتم شد که با تصوری که جی.جی.تامسون از اتم ارائه داده بود متفاوت بود.
در این آزمایش رادرفورد، پرتویی از ذرات سنگین و مثبت آلفا (که به تازگی و در سال ۱۸۹۹ توسط خود او و پائول ویلارد شیمی-فیزیکدان فرانسوی کشف شده بود و از برخی مواد رادیواکتیو ساطع میشد) را به سمت یک صفحهی نازک فلزی مثلا از جنس طلا پرتاب کرد. طبق مدل اتمی تامسون، رادرفورد انتظار داشت که مسیر حرکت تمامی ذرات سنگین آلفا پس از برخورد با این صفحهی نازک، انحراف کمی پیدا کنند. چرا که الکترونها بسیار کوچک و سبک بودند (جرم الکترون قبلا و در سال ۱۹۰۸ توسط فیزیکدان تجربی آمریکایی، رابرت میلیکان کشف شده بود).
از طرف دیگر بار مثبت به شکل یکنواخت در فضای اتم پخش شده بود و غلظت این بار آنقدر بالا نبود که با دافعه، باعث انحراف زیاد ذرات آلفا شود.
نتایج آزمایش اما کاملا برخلاف انتظار رادرفورد بود. رادرفورد مشاهده کرد که بیشتر ذرات آلفا بدون هیچگونه انحرافی از درون صفحهی نازک عبور کردند و تعداد بسیار کمی از ذرات منحرف شدند. اما تعداد بسیار کمی از ذرات آلفا، انحراف خیلی زیاد داشتند. حتی برخی از آنها پس از برخورد، به عقب برگشتند. چیزی شبیه اینکه با یک توپ جنگی به سمت یک دستمال کاغذی شلیک کنید و توپ پس از برخورد به آن، به سمت شما بازگردد.
براساس این آزمایش رادرفورد استدلال کرد که اتم بایستی از یک هسته با بار مثبت و جرم بسیار زیاد (۹۹/۹ درصد از جرم اتم) و الکترونهایی سبک با بار منفی که در فاصلهی دور از هسته، به دور آن میچرخند، تشکیل شده باشد. چیزی شبیه چرخش سیارات به دور خورشید. به همین علت مدل اتمی رادرفورد بعضا تحت عنوان مدل اتمی سیارهای شناخته میشود.
مدل اتمی رادرفورد که به مدل هستهای نیز شناخته میشود، نقش مهمی در درک امروز ما از اتم دارد.